Primera ley de
la termodinámica
También conocida como principio de conservación de la
energía para la termodinámica, establece que si se realiza trabajo sobre un
sistema o bien este intercambia calor con otro, la energía interna del sistema
cambiará.
Visto de otra forma, esta ley permite definir el calor
como la energía necesaria que debe intercambiar el sistema para compensar las
diferencias entre trabajo y energía interna.
Fue propuesta por Nicolas Léonard Sadi Carnot en 1824,
en su obra Reflexiones sobre la potencia motriz del fuego y sobre las máquinas
adecuadas para desarrollar esta potencia, en la que expuso los dos primeros
principios de la termodinámica. Esta obra fue incomprendida por los científicos
de su época, y más tarde fue utilizada por Rudolf Clausius y Lord Kelvin para
formular, de una manera matemática, las bases de la termodinámica.
Que
aplicada a la termodinámica teniendo en cuenta el criterio de signos
termodinámico, queda de la forma.
Donde U es la energía interna del sistema (aislado), Q
es la cantidad de calor aportado al sistema y W es el trabajo realizado por el
sistema.
Esta última expresión es igual de frecuente encontrarla
en la forma.
Ambas expresiones, aparentemente contradictorias, son
correctas y su diferencia está en que se aplique el convenio de signos IUPAC o
el Tradicional.
Segunda ley de
la termodinámica
Esta ley marca la dirección en la que deben llevarse a
cabo los procesos termodinámicos y, por lo tanto, la imposibilidad de que
ocurran en el sentido contrario (por ejemplo, dice algo así como que una mancha
de tinta dispersada en el agua no puede volver a concentrarse en un pequeño
volumen). También establece, en algunos casos, la imposibilidad de convertir
completamente toda la energía de un tipo a otro sin pérdidas. De esta forma, la
segunda ley impone restricciones para las transferencias de energía que
hipotéticamente pudieran llevarse a cabo teniendo en cuenta solo el primer
principio. Esta ley apoya todo su contenido aceptando la existencia de una
magnitud física llamada entropía, de tal manera que, para un sistema aislado
(que no intercambia materia ni energía con su entorno), la variación de la
entropía siempre debe ser mayor que cero.
Debido a esta ley también se tiene que el flujo
espontáneo de calor siempre es unidireccional, desde los cuerpos de mayor
temperatura hacia los de menor temperatura, hasta lograr un equilibrio térmico.
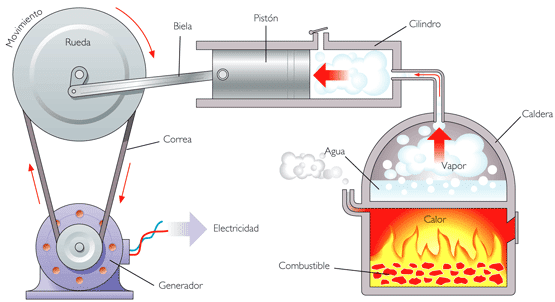
La aplicación más conocida es la de las máquinas
térmicas, que obtienen trabajo mecánico mediante aporte de calor de una fuente
o foco caliente, para ceder parte de este calor a la fuente o foco o sumidero
frío. La diferencia entre los dos calores tiene su equivalente en el trabajo
mecánico obtenido.
Solución de
problemas
1.- ¿Cuál es el incremento en la energía interna de un sistema si se le suministran 700 calorías de calor y se le aplica un trabajo de 900 Joules?
Solución: El problema indica que se le están suministrando 700 calorías de calor, eso quiere decir que 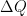 será positivo, por otra parte nos dice que al sistema se le aplicará un trabajo de 900 Joules, aquí el signo de
será positivo, por otra parte nos dice que al sistema se le aplicará un trabajo de 900 Joules, aquí el signo de 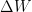 tendrá que ser negativo, puesto que se la están aplicando al sistema.
tendrá que ser negativo, puesto que se la están aplicando al sistema.
Sabiendo ese análisis podemos dar solución al problema de la siguiente forma:
Vamos a convertir las 700 calorías de calor en Joules.
Recordar que  porque como dijimos, al sistema se le está aplicando un trabajo. Ahora conforme a la fórmula de la primera ley de la termodinámica, iniciemos a sustituir.
porque como dijimos, al sistema se le está aplicando un trabajo. Ahora conforme a la fórmula de la primera ley de la termodinámica, iniciemos a sustituir.
despejando ”  “
“
Sustituyendo
Diagrama de flujo
y algoritmo
Inicio
¿Cuál es el incremento en la energía
interna de un sistema si se le suministran 700 calorías de calor y se le aplica
un trabajo de 900 Joules?
Declaración
Q, w ←Enteros
∆U ←Reales
Asignación
Q←2940J
W←900J
Proceso
∆Q=∆u+∆w
Resultado
∆u=3840J
Fin
del algoritmo
Segundo
problema
¿Cuál es la eficiencia de una
máquina térmica a la cual se le suministrarán 8 000 calorías para obtener 25
200 Joules de calor de salida?
Solución: Simplemente tenemos que sustituir los datos en nuestra fórmula:
e = (Q1 - Q2)/Q1
Sustituyendo
nuestros datos:
e = (8000cal – 6000cal)/8000cal
Lo
que sería equivalente a un 25% de eficiencia térmica.
Diagrama de flujo
y algoritmo
Inicio
¿Cuál es la eficiencia de una máquina térmica a la cual se le
suministrarán 8 000 calorías para obtener 25 200 Joules de calor de salida?
Declaración
Q1, Q2←Enteros
e ←Reales
Asignación
Q1←8000cal
Q2←6000cal
Proceso
e = (Q1 - Q2)/Q1
Resultado
e=0.25
Fin
del algoritmo




No hay comentarios:
Publicar un comentario